2024/12/2 (更新日:2024/12/2)
はじめてでもわかる燃料電池による発電の仕組みと燃料電池の種類による違い【初心者用】

革新的なエネルギー技術である燃料電池による発電の仕組みをご存知でしょうか?
水素と酸素から、水を排出するだけで電気をつくれる燃料電池発電の仕組みを解説いたします。また、4種類ある燃料電池についての違いも明らかにします。
燃料電池発電のメカニズムを理解して、環境に優しいと言われているところを自ら判断してください。
目次
- 燃料電池による発電の仕組みと燃料電池の種類
- 燃料電池による発電の仕組み
- 燃料電池の種類による違い
1.燃料電池による発電の仕組みと燃料電池の種類

燃料電池は、【 水の電気分解の逆反応=水素と酸素の化学反応 】により電気と熱を発生させる技術です。
発電に限定すると、発生するのは水のみで二酸化炭素は発生しません。
化学反応を利用した発電なので、振動や騒音の少なく環境に優しい方式とされています。
良いことばかりではないはずなので、中身を確認していきましょう。
1-1. 燃料電池発電の効率
発電効率:35~60%(目安)
*発電時に発生する排熱を回収して冷暖房などに有効利用するコジェネレーションシステムを導入すると、総合的な効率で ” 80% ” 程度まで向上が可能です。
1-2. 燃料電池発電のメリット
(1) 発電時に二酸化炭素(CO2)や、大気汚染の一因となる窒素酸化物(- N -)を排出しません。
(2) 小規模な発電設備を比較的短期間で設営できるので活用しやすいです。
(3) 発電時に、騒音・振動が少ないです。
(4) 充電が不要で安定的に発電し電力を供給できて非常用電源になります。
(5) 使う場所で発電できるため送電損失を減らすことができます。
1-3. 燃料電池発電の課題
(1) 燃料電池に使用する水素(H2)を造るときに、二酸化炭素を発生します。
(2) まだ、コストが高い。特に触媒のコストが高いです。
(3) 7~8年程度で効率が大幅に低下するので寿命が長くありません。
(4) 水素(H2)を供給する改質装置*の普及が進んでいません。
改質装置*
原料に天然ガスやガソリンを使い、改質して水素を作る例が多い。
2.燃料電池による発電の仕組み

燃料電池は、水素と酸素の化学反応により、電気を発電する装置です。
燃料電池は、水の電気分解の逆の反応で発電します。
自然に存在するエネルギーや燃焼により作り出したエネルギーを電気に変換するものではありません。
また、蓄電池のように電気を貯める機能はありません。
燃料電池の発電の仕組みを、代表的な燃料電池*1 で説明します。
代表的な燃料電池*1
:固体高分子形燃料電池 (PEFC)、りん酸形燃料電池 (PAFC)
固体高分子形燃料電池 (PEFC)は電解質がイオン交換膜、
りん酸形燃料電池 (PAFC)は電解質がリン酸という違いがあります。
2-1. 燃料電池が発電する原理
(1) 燃料電池セルで発電する原理
燃料電池の構成単位の燃料電池セル(単電池)での化学反応を説明します。
燃料電池セル
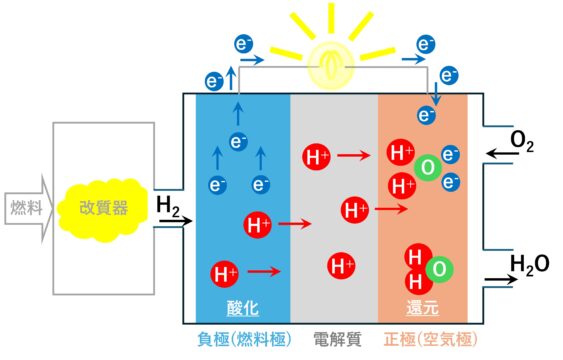
負極(燃料極)(アノード)では、酸化反応がおこります。
水素(H2)が白金の触媒作用により水素イオン(H+)と電子(e-)に分解されます。
H2 → 2H+ + 2e-
水素イオン(H+)は、電解質を通り正極へ移動します。
電子(e-)は、電線を通り正極へ移動します。
正極(空気極)(カソード)では、還元反応がおこります。
酸素(O2)が電解質を通ってきた水素イオン(H+)と電線から供給される電子(e-)が反応して水を作ります。
1/2O2 + 2H+ + 2e- → H2O
電極間を電線で外部回路につなぐことで電流が流れ発電することになります。
例では、電灯が点灯します。
(2) 燃料電池セルの構造
燃料電池セル単体で発生する電圧は、約 0.7V / 1セルになります。
実際に使用するときは、電圧を高くするために多数のセルを積層するのが一般的です。
積層するときのセルの構造を説明します。
燃料電池セルの構造
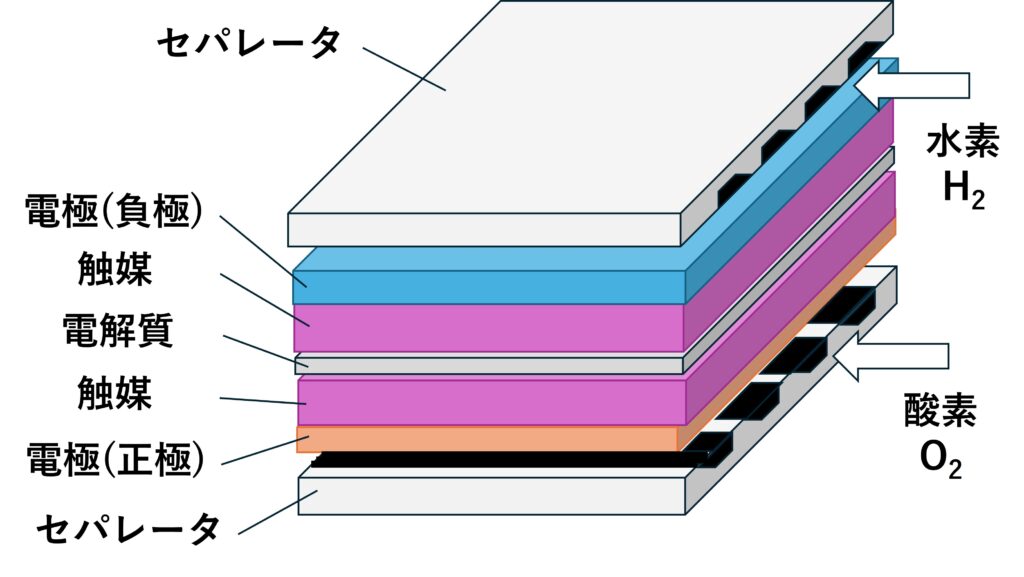
電解質を電極で挟み込み、さらにセパレータで挟む構造になっています。
電極部は電極と触媒からできていて、電極はカーボン、触媒は白金が使われています。
電解質は、一般にイオン交換膜(高分子膜)が使われます。
電極(負極)に水素(H2)、電極(正極)に酸素(O2)が流されると、電極の触媒層で科学反応が起こります。
その結果、発電し電流が流れます。
2-2. 燃料電池発電のシステム構成
燃料電池は使われ方によりシステムは構成が変わりますが、ここでは電気を利用するための一般的な発電システムについて説明します。
燃料電池セル単体で発生する電圧は、約 0.7V / 1セルなので、使用する電圧・電力に応じて積層して使用します。
燃料電池発電システムでは、電気を発電するとともに、発電時に発生する熱を再利用するのが一般的です。
電気を発電する燃料電池発電と排熱を再利用するコジェネレーションで構成されます、
(1) 燃料発電の全体システム
燃料電池発電システム
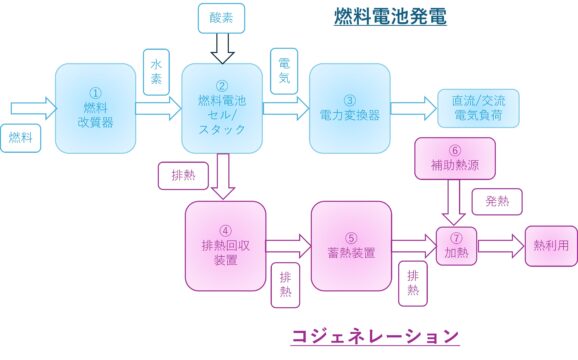
燃料電池発電の流れと用語の説明
燃料電池発電
①燃料改質装置:燃料から水素を生成します。
②燃料電池セル/スタック:水素と酸素(空気)から化学反応で直流電気を発生させます。スタックでは、セル単体を直列に接続して実際に必要な電圧にして電気を供給します。
③電力変換器:燃料電池で発生する直流電気を安定した直流/交流に変換して電気負荷に供給します。
コジェネレーション
④排熱回収装置:燃料電池セル/スタックで発生する熱(排熱)を回収し、家庭などの場合は温水をつくります。
⑤蓄熱装置:温めた温水をためて保温しています。必要があるときに供給します。
⑥補助熱源:蓄熱槽に蓄えられた温水の温度が低い場合、エネルギーを加えるために外部で熱をつくります。例えばガスの燃焼による方法などがあります。
⑦加熱:補助熱源の熱を加えて、必要な温度の温水にして熱を供給します。
家庭用燃料電池を施設するときの決まり事
1. 安全上、電気に関する知識が少ない人でも、燃料電池の発電・停止・異常発生を認識できるように、運転状態を表示する装置を施設するように、電気使用場所での施設について電気設備技術基準で決められています。
2. 一般的に停電時に、非常用予備電源として使用する場合は、常用する電源と電気的に接続しないように使用しないといけません。停電時に電線路を調査する作業員が感電しないように非常用予備電源と常用電源の電気的な接続を遮断する機能(インターロック等)が必要です。
3. 異常と思われる下記の状態が生じた場合、燃料電池を自動的に電路から遮断し、燃焼ガスの供給を自動的に遮断し、燃焼ガスを自動的に排除する装置を燃料電池に施設する。
3-1) 過電流が流れた場合
3-2) 発電電圧の異常低下した場合
3-3) 燃焼ガス出口における酸素濃度or空気出口における燃焼ガス濃度が著しく上昇した場合
3-4) 燃料電池の温度が著しく上昇 した場合
4. 燃料電池の絶縁耐力試験
最大使用電圧(燃料電池の発電電圧)の1.5倍の直流電圧を端子と大地との間に連続して10分間加えたとき、絶縁破壊がないこと
(2) 燃料電池発電のメインシステム
燃料電池発電の中心部分については、詳しく触れておきます。
燃料電池発電の心臓部
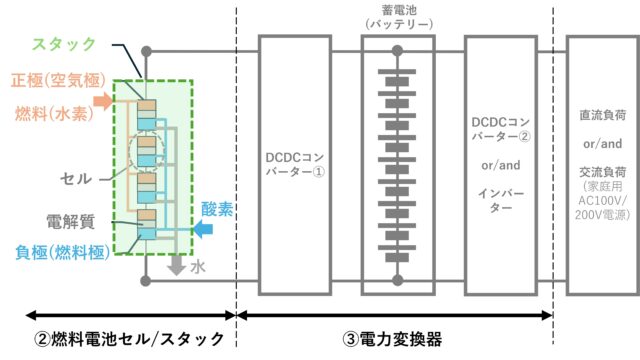
用語の説明
スタック:燃料電池のセルを直列・並列接続して必要な電圧・電流が取り出せる様に構成。セルの集まりの安全をコントロールする制御装置などとまとめてケースに一体化した構造です。
DCDCコンバーター①:燃料電池で発電した電力を蓄電池に無駄なく充電する装置。電圧、充放電量をコントロールして、燃料電池の直流電力から蓄電池の直流電力に変換します。
DCDCコンバーター②:蓄電池から直流電気負荷に適した直流電圧に変換する電力変換装置
蓄電池(バッテリー):発電して電力を蓄えておきます。リチウムイオン電池、ニッケル水素電池、鉛蓄電池などが使われています。
インバーター:直流電力を交流電力に変換する装置
直流・交流負荷:直流・交流で動作する電子機器。燃料発電を電源にして動作するものを負荷と表現している。
上記、1章と2章で説明したのは、固体高分子形燃料電池(PEFC)、りん酸形燃料電池(PAFC)になります。
3.燃料電池の種類による違い

燃料電池にはいくつかの種類があります。
燃料電池の方式によっては、電解質を移動するイオンが水素イオンの代わりに、炭酸イオン(CO32-)、酸素イオン(O2-)となる場合がありますが、アノードからカソードへ電線を通って電子が流れるという原理は同じです。
3-1. 燃料電池:固体酸化物形燃料電池(SOFC)の発電原理
電解質は、セラミクスの安定化ジルコニアが一般的で、酸化イオン伝導性を持つ固体酸化物です。
媒体イオンを、水素イオン(H+)の代わりに、酸素イオン(O2-)を使います。
燃料電池:固体酸化物形燃料電池(SOFC)
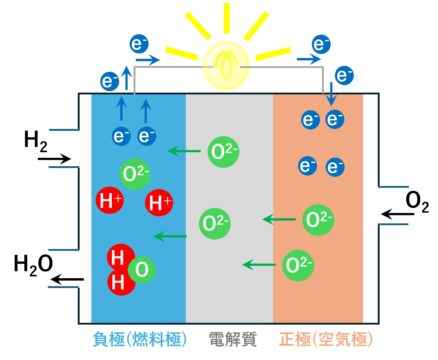
負極(燃料極)(アノード)には、酸化ニッケル(Ni)が使われます。
ニッケル(Ni)の触媒作用により、水素(H2)と酸素イオン(O2-)が反応し、水と電子(e-)に分解します。
O2- + H2 → H2O + 2e-
電子(e-)は、電線を通り正極へ移動します。
正極(空気極)(カソード)では、
酸素(O2)が電線から供給される電子(e-)を受取り、酸素イオン(O2-)を作ります。
1/2O2 + 2e- → O2-
酸素イオン(O2-)は、電解質を通り負極へ移動します。
3-2. 燃料電池:溶融炭酸形燃料電池(MCFC)の発電原理
電解質を、炭酸リチウム等(Li2CO3):炭酸リチウム・炭酸ナトリウムの混合物
媒体イオンを、水素イオン(H+)の代わりに、炭酸イオン(CO32-)を使います。
燃料電池:溶融炭酸形燃料電池(MCFC)
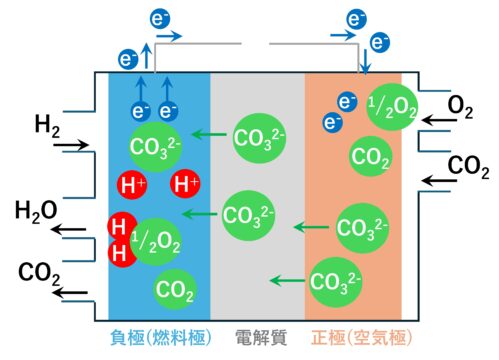
負極(燃料極)(アノード)には、ニッケル(Ni)が使われます。
ニッケル(Ni)の触媒作用により、水素(H2)と炭酸イオン(CO32-)が反応し、水と二酸化炭素(CO2)と電子(e-)に分解します。
H2+CO32-→H20+CO2+2e–
電子(e-)は、電線を通り正極へ移動します。
正極(空気極)(カソード)では、
酸素(O2)と二酸化炭素(CO2 )が電線から供給される電子(e-)を受取り、炭酸イオン(CO32-)を作ります。
1/2O2 + CO2 + 2e- → CO32-
炭酸イオン(CO32-)は、電解質を通り負極へ移動します。
3-3. 燃料電池の種類と違い
説明してきた燃料電子発電についてまとめました。
燃料電池発電方式の種類による比較表
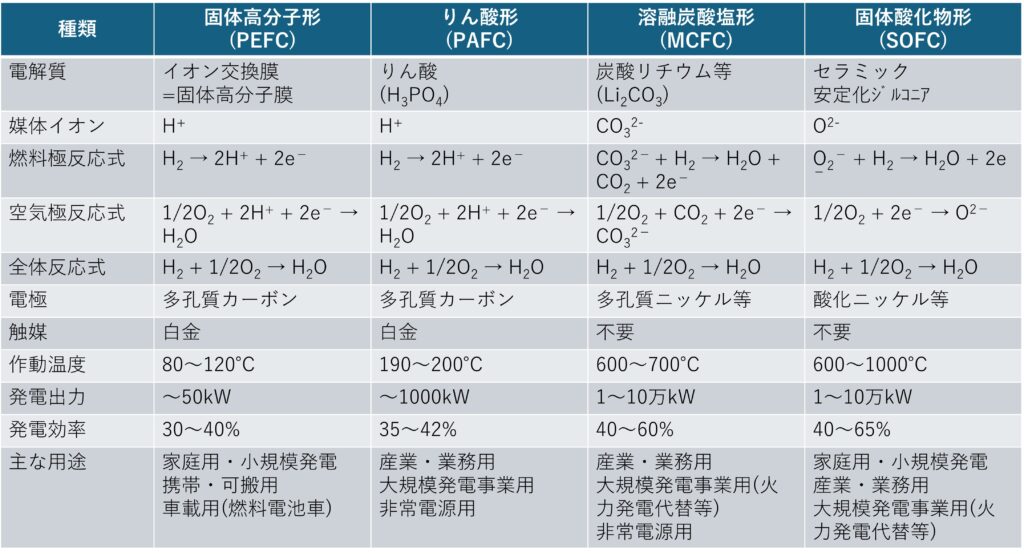
*他に宇宙開発などの特殊用途向けにアルカリ形燃料電池(AFC)があります。
効率が高いのですが、地球上での実用に適さないと言われているので省略します。
4.まとめ

燃料電池発電について解説しました。
燃料電池発電自体は環境には優しいと言われていますが、改質器を含めた周辺装置も考慮する必要があります。
他の発電方式に比べて発電効率の良い燃料電池発電をどのように活用したら良いかぜひ考えてみてください。
最後まで読んでいただきありがとうございます。
説明できる内容は限られていますが、極力正確に伝えるように心がけました。
足りない部分、適切でない部分、補足などが有りましたらご指摘等お願いいたします。
Copyright–Seiji Nakamura, 2024 All Rights Reserved.












